Anotações sobre o livro: História De Uma Vacina
Published on
“ajudando a preparar o mundo para as próximas epidemias. Pois elas virão.”

O livro “História de uma vacina”, lançado pela editora Intrínseca em 2021, conta a história do teste clínico da vacina de Oxford/Astrazeneca realizado no Brasil, sob liderança da cientista brasileira Sue Ann Costa Clemens. Tudo começa com um convite:
“Sue, você tem interesse em fazer o estudo da nossa vacina no Brasil?” Minha primeira reação foi: “Você quer isso para quando?” Naquela época, eu já estava envolvida com o desenvolvimento de duas vacinas para a covid-19 — uma de RNA mensageiro, da empresa alemã CureVac, e outra baseada em proteínas, da chinesa Clover. Eu era membro do comitê científico de ambas, mas os projetos ainda estavam muito distantes da fase 3, de comprovação da eficácia. A oportunidade que Andrew me oferecia naquele momento era a de estar na linha de frente e tentar acelerar o processo de testagem muito antes do que eu esperava. Era a chance de pôr em prática as habilidades que desenvolvi ao longo de uma carreira dedicada às vacinas e de salvar vidas em meio a uma crise sanitária sem precedentes na história recente. Ao terminarmos a reunião, quase sem perceber, eu já havia começado a saga para que o Brasil tivesse um braço da pesquisa de Oxford e, assim, pudesse ter acesso a uma das mais promissoras vacinas contra a covid-19 em desenvolvimento no mundo.
O livro também conta detalhes de como foram montadas as equipes que coordenaram os estudos em diferentes centros de pesquisas brasileiros, como se deu o financiamento para o estudo (através dos parceiros Fundação Lehman, Rede D’or, Centro de Referência para Imunobiológicos Especiais - ligado á Unifesp, Fiocruz), e sua interação com o governo federal na época do ministro Nelson Teich.
Nelson Teich duraria pouco tempo no governo. Sua atuação foi importante para promover articulações essenciais para a pesquisa, como uma reunião da Anvisa com a MHRA (Medicines and Healthcare products Regulatory Agency). Mas ele deixou o posto no ministério ainda em maio, menos de um mês depois de assumir, e não chegou a ver o estudo ser aprovado pela Anvisa, o que aconteceu logo no início de junho.
Trevor lembrou que, em abril de 2020, havia me apresentado ao CEO da Fundação Lemann, Denis Mizne. Na ocasião, a entidade ligada ao empresário Jorge Paulo Lemann tinha manifestado interesse em investir em projetos de vacinas para a covid-19. Ainda que o foco da fundação seja a educação, Denis vinha pensando no que a organização poderia fazer para ajudar na saúde desde uma conversa em que o próprio Jorge Paulo Lemann, que preside o conselho, dissera estar disposto a apoiar alguma iniciativa importante na área. Algo que fosse grande e decisivo. Na avaliação deles, o Brasil estava deslocado do debate de vacinas, dizendo que não ia aderir às regras da OMS, num momento de tensão e antagonismo, com todo o debate voltado para equipamentos de proteção e leitos de UTI. O CEO da Fundação Lemann passou então a acionar contatos pelo mundo, a fim de, como ele mesmo diz, “aprender” de que forma poderia ajudar. Havia sido o protagonismo da Fundação Gates na área da saúde (e de vacinas) que levara Denis Mizne a Trevor Mundel. O brasileiro tinha perguntado ao executivo da entidade o que ele faria se estivesse no Brasil. Trevor teria respondido que o país precisava entrar no mapa da vacina, e o melhor jeito de fazer isso era abrigar testes clínicos — então ele fez a ponte e me apresentou por e-mail ao CEO da Fundação Lemann.
Foi para ela, Lily Weckx, que telefonei logo depois da conversa com Andrew. Lily é diretora do Centro de Referência para Imunobiológicos Especiais (Crie), um espaço de vacinação da Unifesp especializado no atendimento de pacientes com risco aumentado para doenças infeciosas, que oferece vacinas não ofertadas nos postos regulares e acompanha possíveis eventos.
Na época, eu já tinha adotado o que passei a chamar de “ritmo covid” — precisava avançar mais rápido do que a doença que, naquela semana, registrava por aqui, em média, 10 mil novos casos por dia. Enviei um e-mail a Denis Mizne já com Andrew Pollard em cópia, explicando que ele era o chefe da pesquisa da vacina de Oxford e que gostaríamos de fazer os testes no Brasil. Denis respondeu no ato. Marcamos uma reunião para a manhã do dia 10 de maio. Ele foi direto: “Não me mande nada, não preciso de projeto detalhado, cuide da vacina. Gaste 100% do seu tempo fazendo isso. Eu vou checar se conseguimos o patrocínio. Já prometo que não vou dar trabalho e vou ser rápido.” E de fato ele foi. Pouco depois, já nos enviou um e-mail com a resposta. Denis tinha telefonado para Jorge Paulo Lemann no instante em que encerramos nossa conversa e contou que introduziu o assunto ao empresário com a frase: “Acho que encontrei aquele projeto grande e decisivo.” Ele explicou a Lemann que a vacina de Oxford era a primeira a chegar nos testes de fase 3 e perguntou se podia embarcar no projeto. Fiquei surpresa com a rapidez da resposta de Denis. Achei que levaria dias para ouvir algo, mas em minutos ele escreveu e disse apenas: “Está aprovado.” Eu chorei, e meses depois, quando encontrei Denis pessoalmente, em São Paulo, ele me confidenciou que também tinha me dado a resposta com lágrimas nos olhos.
O patrocínio da Fundação Lemann cobriria todos os custos do estudo em São Paulo. Para os testes no Rio, porém, eu ainda não tinha um patrocinador, mas imaginava quem procurar. Acionei Rodrigo Gavina, cirurgião torácico e vice-presidente da Rede D’Or. Nos anos 2000, em meio à pesquisa da vacina do rotavírus, o maior estudo que eu tinha feito até então e um dos maiores estudos de fase 3 da história, tive seguidos pneumotórax — quando o pulmão colapsa e uma bolha de ar surge entre as duas camadas da pleura, a membrana que reveste o órgão. O tratamento é cirúrgico. Foi Rodrigo quem me operou e acompanhou minha recuperação, e acabamos ficando amigos. Quando telefonei para ele com a intenção de pedir financiamento para a pesquisa, eu já estava tão submersa que me esqueci que era domingo. Ele estava voltando de uma viagem com a família, na estrada, e insistiu para que eu contasse o motivo da ligação. Eu me segurei e telefonei de volta na segunda-feira. Rodrigo era minha melhor ponte com a Rede D’Or, o maior grupo hospitalar privado do Brasil e que tem um braço dedicado à pesquisa, o Instituto D’Or, cuja sede fica no Rio de Janeiro. Naquele momento da pandemia, em que o sistema de saúde se debatia para driblar o colapso, os investimentos da rede estavam voltados aos hospitais de campanha e tinham sido criados 500 novos leitos de UTI para atender pacientes de covid. Rodrigo hoje comenta que não se falava de vacina naquela época como viria a se falar depois, e Oxford estava na frente. Ele então levou o projeto ao fundador da Rede D’Or, Jorge Moll Filho, que, por sua vez, deu o aval para o financiamento do estudo. Segundo Rodrigo, quando foram erguidos os hospitais de campanha a busca por parceiros levou uma semana, mas com a vacina, não — era uma decisão que precisava ser tomada de um dia para o outro, não havia tempo para pensar.
Uma semana depois da reunião virtual com Oxford, já tínhamos patrocinadores e os dois centros de testes definidos. No Rio, a sede do estudo seria o Instituto D’Or, um prédio inteiro em Botafogo que nos foi cedido pela rede para recrutar e vacinar os voluntários. Em São Paulo, sob a batuta de Lily Weckx, faríamos a pesquisa no galpão da Unifesp, cuja reforma, patrocinada pela Fundação Lemann, começou antes mesmo de termos o protocolo do estudo aprovado pelo governo brasileiro — um risco que valia a pena correr.
Vacinas
A fórmula foi batizada de ChAdOx1 nCoV-19, ou Chadox, na versão abreviada que adotamos informalmente nos corredores dos centros. Como a Universidade de Oxford assinou um acordo com a farmacêutica AstraZeneca, a Chadox também passou a atender por AZD1222, contemplando letras do nome da indústria.
Na pandemia de Covid-19, diferentes tipos de vacinas foram desenvolvidas. Foi um grande esforço que envolveu grande parte da humanidade, empresas e governos do mundo todo trabalharam para criar vacinas seguras e eficazes no menor tempo possível. O resultado foi que em menos de 2 anos de pandemia, grande parte do mundo está sendo imunizada.
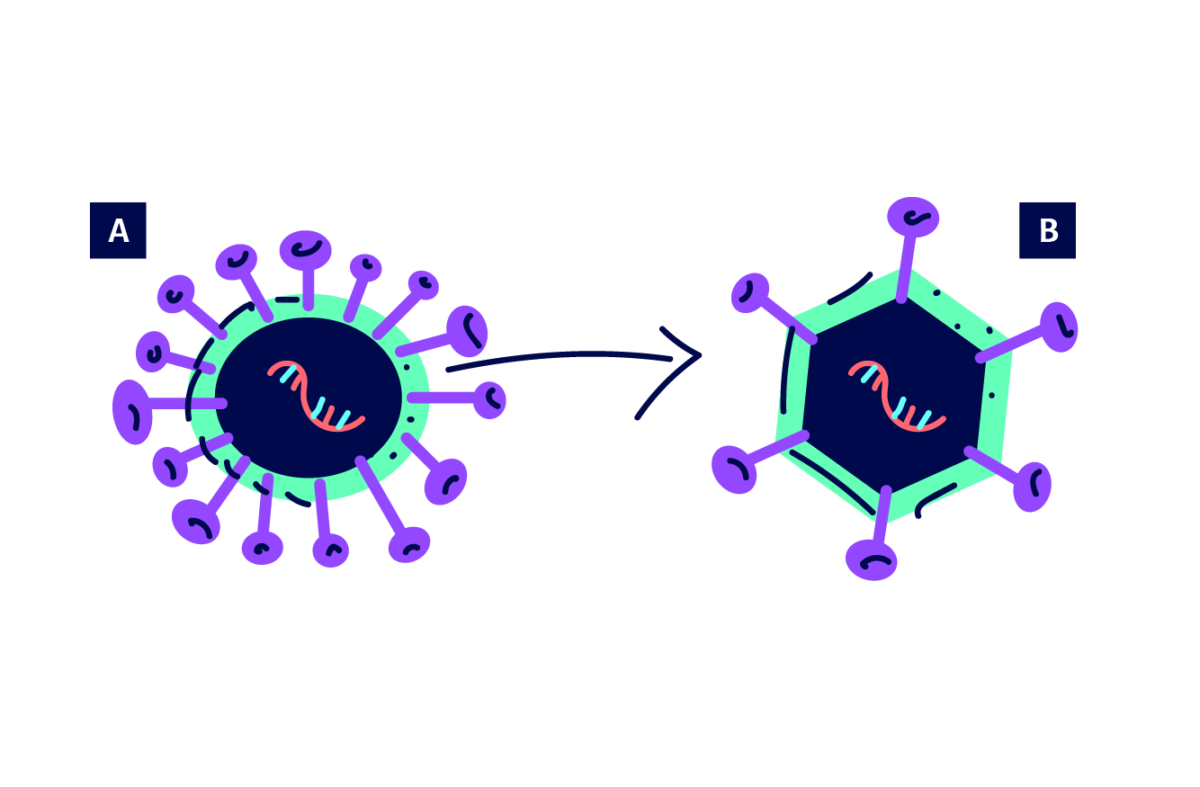 Esquema didático de uma vacina de vetor viral, onde onde o material genético de um coronavírus (A) é usado em outro vírus (B) que é aplicado pela vacina. Fonte: UFRJ
Esquema didático de uma vacina de vetor viral, onde onde o material genético de um coronavírus (A) é usado em outro vírus (B) que é aplicado pela vacina. Fonte: UFRJ
A vacina da Oxford/Astrazeneca (no Brasil ela é produzida pela Fiocruz) usa um vetor viral não replicante (um adenovirus, sem capacidade de se replicar no organismo) para levar ao nosso corpo um pedaço de instrução genética que produz anti-corpos para a mesma proteína que o SARS-COV-2 usa para infectar nossas células.
- Podcast: Escuta a Ciência - menu de vacinas
- Podcast Resposta imune
- OMS: Como funcionam as vacinas
- UFRJ: Especial Vacinas
A primeira a divulgar foi a americana Pfizer. Seu produto, desenvolvido em parceria com a alemã BioNTech, tinha 95% de eficácia. Foram identificados 94 casos de covid-19 num universo de mais de 43 mil voluntários, segundo a empresa, que viria a confirmar a elevada eficácia mais de um mês depois, em 31 de dezembro, com um artigo publicado no New England Journal of Medicine.1 A empresa tinha, então, dados mais robustos: no mesmo número de voluntários, coletou 162 casos de covid-19 no braço que recebeu placebo e apenas oito entre os que receberam a vacina em teste.
Depois da Pfizer fazer seu anúncio à imprensa, foi a vez de a Moderna exibir os resultados, ainda em novembro.2 A farmacêutica americana relatou ter 94% de eficácia. Um pool de especialistas independentes mostrou que 95 participantes dos 30 mil recrutados pelo estudo da Moderna foram diagnosticados com a covid-19. Desses, apenas cinco eram do grupo que recebeu o imunizante desenvolvido pela empresa, e os demais, placebo.
No material exibido pelo chefe dos estudos naquela tarde de domingo,3 eu via três percentuais diferentes — e a chance de confusão. O primeiro mostrava que, se aplicada meia dose, a eficácia era maior, chegava a 90%. Com as duas doses completas, inteiras, o percentual era menor, de 62% no Reino Unido e 64% no Brasil. O terceiro número era a média dos dois anteriores e resultava no que chamamos de eficácia global, de 70,4%. Eu comecei a pensar nas perguntas cujas respostas não estavam nos slides, como: Qual era a eficácia com uma só dose? Nossa vacina inicialmente tinha a estratégia de uma dose e mudamos de forma súbita devido a resultados muito positivos, mas parciais. Em um desenvolvimento clínico normal, teríamos explorado ambas as estratégias — com apenas uma ou com duas doses, além de diferentes intervalos e concentrações — para decidir. Mas não tinha nada de normal na situação que o mundo vivia, e queríamos produzir o mais rápido possível uma vacina segura e eficaz.
Na segunda-feira, dia 23 de novembro de 2020, num primeiro momento, os jornais usaram a informação dos 90% de eficácia. Mas esse era o percentual referente à meia dose, que não o era objeto do registro, e não tardou para que surgisse a pergunta: Por que meia dose? No mesmo dia, em entrevista à agência Reuters, Mene Pangalos, vice-presidente executivo de biofarmacêuticos da AstraZeneca, disse que a meia dose foi uma “feliz coincidência” e, depois, afirmou: “Sim, foi um erro.” Não, não foi um erro. E também não era uma feliz coincidência. Houve uma diferença na produção da vacina que, antes, nos testes iniciais, era fabricada no Reino Unido e, depois, passou a ser produzida por uma empresa italiana. Notou-se que o número de partículas virais por dose num determinado lote era menor. Avisamos às agências regulatórias do Reino Unido e do Brasil sobre a diferença de dosagem e decidimos, em conjunto com essas agências, manter no estudo o grupo — só de voluntários britânicos — que havia recebido a meia dose. Era uma forma de explorar um regime e uma concentração diferentes de doses, algo que se faz em pesquisa, parte normal do desenvolvimento de uma vacina em fase 2. Foi uma decisão consciente, com recomendação, aval e acompanhamento das agências envolvidas. Mas a diferença da eficácia da vacina no grupo que havia tomado meia dose seguida de uma dose de reforço e do grupo que recebera as duas doses padrão era, de fato, “intrigante”, como definiu Andrew Pollard à imprensa. Ele próprio completou: “Para entender, mais estudos serão necessários.”
Nossa análise interina de eficácia foi publicada ainda em dezembro de 2020, na revista Lancet.4 Fomos os primeiros a publicar um artigo científico — com a revisão de pares, algo da maior importância para atestar a credibilidade do estudo — sobre a terceira e última fase de testes de uma vacina para o coronavírus. O trabalho esmiúça os dados que haviam sido apresentados à imprensa em novembro, com informações detalhadas sobre as reações adversas, a meia dose, o perfil de idade e gênero de nossos recrutados, entre outras minúcias que confirmam o rigor com que conduzimos os estudos para a elaboração daquela análise interina.
Sarah Gilbert — a cientista que desenvolveu a fórmula de Oxford, uma espécie de mãe biológica da vacina — é pesquisadora nessa área há mais de vinte anos. Trabalhou, por exemplo, no desenvolvimento de imunizantes para o ebola e para a síndrome respiratória do Oriente Médio, a MERS. Como mencionei antes, foi essa pesquisa que deixou Oxford à frente na corrida pela vacina para a covid-19, tendo iniciado os testes pelo menos oito semanas antes das outras produtoras. Também causada por um coronavírus, a MERS vinha sendo estudada pelo time de Sarah Gilbert desde 2019. Em janeiro de 2020, com o código genético do SARS-CoV-2 sequenciado em Oxford por Teresa Lambe, o grupo apenas adaptou a plataforma para o novo antígeno. Até então desconhecido fora de seu país, o trabalho da cientista ganhou notoriedade na pandemia.
Como é realizado um estudo clínico de uma vacina
Com uma linguagem de fácil compreensão, a autora nos explica como são realizados os estudos de fase 3 das vacinas, onde se busca comprovar a eficácia. Ela explica porque esses estudos são bem rigorosos no acompanhamento dos dados, usando varias técnicas diferentes para minimizar erros e vieses.
Denise Abranches, cirurgiã-dentista e coordenadora da odontologia do Hospital São Paulo. Despachada, ela dizia aos funcionários na entrada: “Acaba logo isso, gente, que eu quero entrar.” Eu ri. Denise era a primeira voluntária — e estava ali brigando para manter seu título. Fora a primeira a se inscrever e chegara na manhã de sábado horas antes da abertura, para garantir que não haveria outro inscrito mais rápido que ela. E não houve. Denise foi, como gosta de dizer, a primeira pessoa a entrar na pesquisa para a covid-19 no Brasil, a nossa número 1.
O voluntário, a depender do sistema de randomização, poderia receber a Chadox ou a meningocócica ACWY. Nem voluntários nem funcionários sabem qual vacina foi aplicada. Os dados são revelados apenas ao final da fase 3, quando são feitas as análises de eficácia.
foi de Mariana a solução para aumentar o recrutamento de idosos. Sabendo que precisava comunicar o convite onde eles estavam, ela teve a ideia de ir a uma igreja próxima do centro, na missa de domingo, e pedir ao padre que anunciasse o estudo.
Por fim, antes de partir, o voluntário recebia uma ajuda de custo para o transporte. Não se trata de uma remuneração pela participação na pesquisa, algo que não é permitido pela comissão nacional de ética do Brasil, mas apenas o custeio do deslocamento até o centro, para que dificuldades financeiras não impedissem o engajamento na pesquisa.
Além disso, o progresso do estudo são acompanhados de perto por um comitê independente, que busca assegurar a segurança e a ética no tratamento aos voluntários. Nessa área o Brasil é bem avançado, apesar de alguns reveses recentes.
Cooperação internacional e rede de contatos
Opas, a Organização Pan-Americana da Saúde, peça-chave para as pesquisas e introdução de vacinas na América Latina. O chefe de vacinas na Opas era, então, Ciro Quadros, que mais tarde seria nomeado pela OMS o “herói das Américas em saúde pública”. Ele era temido na indústria, conhecido por nem mesmo receber os médicos das empresas e por ser duro nas reuniões. Era uma ponte importante para projetos como o do rotavírus. E eu conseguia fazer esses contatos por conta do respeito conquistado como pesquisadora acadêmica. Por muitos meses, eu pegava o trem cedo na Filadélfia em direção a Washington, onde está a sede da Opas, na esperança de me encontrar com membros do comitê de vacinas, jamais esperando ser recebida pelo grande chefe, só por alguém de seu time. Iniciei as conversas semanais apresentando o projeto de desenvolvimento clínico, os estudos epidemiológicos e suas atualizações. Quando o próprio Ciro Quadros apareceu no meio de uma das reuniões, gelei. Fiquei sem palavras. E lá estava ele: o homem que interrompeu uma guerra na África para vacinar contra a varíola e ajudar na erradicação do vírus. Eu mal podia acreditar.
O apoio de Ciro Quadros foi fundamental para o desenvolvimento e registro da vacina de rotavírus da GSK e abriu muitos caminhos para um melhor entendimento entre a indústria e a Opas. Aprendi muito com ele e tenho a honra de dizer que trabalhamos muito juntos, e por muitos anos, até que ficamos amigos. Eu o convidei para a palestra de abertura do mestrado em vacinologia da Universidade de Siena, anos mais tarde. Foi um grande reconhecimento tê-lo pessoalmente na inauguração. Depois, já na Fundação Gates, em projetos como o da nova vacina da pólio, eu o chamei para presidir o comitê independente de segurança, função que ele cumpriu de forma brilhante até seus últimos dias. Doutor Ciro, como eu o chamava, morreu em 2014 e foi um nome fundamental para a erradicação da pólio nas Américas. Semanas antes de sua partida, durante uma reunião de comitê em que eu representava a Fundação Gates, já bem abatido, ele segurou minha mão e disse: “Sue, corra com esses resultados para que eu possa ver uma nova vacina nascendo.” Infelizmente, isso não aconteceu. O “herói das Américas”, que contribuiu para o desenvolvimento da nova vacina oral para a pólio, não pôde ver a fórmula registrada, o que só aconteceria anos mais tarde.
Um aspecto que achei muito interessante no livro é sobre a importância de criar e manter uma rede de contatos. Ao longo dos capítulos a autora demonstra que nos diversos lugares em que trabalhou, buscou fazer cooperações que se mostraram valiosas durante a sua carreira. Ela conta como começou a trabalhar para a fundação Bill & Melinda Gates, e como isso foi essencial para o estudo clínico que ela liderou no Brasil.
Bill Gates sabia que, iniciada a corrida pela vacina no primeiro trimestre de 2020, dezenas de imunizantes chegariam à fase de testes clínicos até o final daquele ano. Para que isso pudesse acontecer, os produtos tinham de encontrar centros de recrutamento e acompanhamento de voluntários preparados. Caso contrário, corria-se o risco de ter fórmulas prontas à espera e competindo por centros, profissionais e ambientes equipados para os testes. A epidemiologia e a localização geográfica também eram parte importante da escolha dos centros — daí a relevância de se preparar vários deles ao redor do globo. Não sabíamos como a pandemia iria se comportar e quanto tempo iria durar; nesse contexto, esperar estava fora de cogitação.
Desde o início de 2020, a organização do fundador da Microsoft esteve envolvida com o desenvolvimento de tratamentos e vacinas para a covid-19. Em março daquele ano, Bill Gates foi a público instar as farmacêuticas a trabalharem com agilidade e cooperação, pedindo que compartilhassem dados para contribuir com o combate à pandemia. Seu envolvimento com emergências sanitárias globais vinha de muito antes, desde a criação da CEPI, a Coalizão para Inovações em Preparação para Epidemias. Trata-se de uma espécie de consórcio formado por governos (como Noruega, Alemanha, Reino Unido, Japão entre outros) e fundações filantrópicas (como BMGF e Wellcome Trust), lançado oficialmente no Fórum Econômico Mundial de Davos em 2017, com a missão de direcionar recursos para a produção de vacinas. A importância da CEPI foi reforçada num encontro em Berlim em 2018, com a presença de Bill Gates, Angela Merkel e outros líderes. Eu estava lá e pude testemunhar decisões importantes para a saúde pública global. Foram revisados marcos de desenvolvimento de algumas vacinas, como as de tuberculose, e anunciou-se a criação do primeiro escritório da Fundação Gates na Alemanha. Naquele encontro, o maior investidor do consórcio, a Noruega, mostrou que voltaria o foco para financiamentos de projetos de imunizantes contra doenças com potencial de causar epidemias, identificadas pela OMS em uma lista chamada blueprint. As cinco doenças prioritárias da lista eram: febre de Lassa, infecção pelo vírus nipah, chicungunha, febre de Rift Valley e MERS, a síndrome respiratória causada por um tipo de coronavírus. Era este, aliás, o patógeno com o qual Oxford já lidava no início de 2020, com recursos da própria CEPI. Com pequenos ajustes, a universidade pôde adaptar o trabalho para o SARS-CoV-2, causador da covid-19, e assim saiu na frente na corrida por uma vacina para o novo coronavírus.
interesse de Bill Gates por saúde global começou no final dos anos 1990, quando, como ele gosta de contar, leu no New York Times uma reportagem sobre os milhares de crianças em países pobres que morriam vítimas de doenças para as quais havia prevenção ou que já estava até mesmo erradicadas nos Estados Unidos. Então, o fundador da Microsoft mandou o artigo do jornal ao pai, William H. Gates Sr., com uma mensagem: “Pai, talvez possamos fazer algo para resolver isso.” Pouco tempo depois, no ano 2000, surgia a Fundação Bill e Melinda Gates, que, em duas décadas, investiu mais de 50 bilhões de dólares em projetos de educação e saúde, como o desenvolvimento de medicamentos e vacinas.
Como as vacinas para COVID-19 foram desenvolvidas de forma tão rápida?
O livro traz importantes esclarecimentos sobre essa questão. Em momento algum a segurança foi sacrificada para conseguir um desenvolvimento mais veloz dos imunizantes, o que mudou foi o nível de cooperação internacional (entre organizações do setor público e privado), compartilhamento de informações cientificas de forma muito mais rápida e aberta, e muito investimento para lidar com a emergência global de COVID-19.
Eu me propusera a conversar com os Estados Unidos porque conhecia o diretor da Operação Warp Speed, Moncef Slaoui. Ele dirigia a força-tarefa do governo americano criada ainda no início da pandemia, em maio de 2020, para apoiar seis projetos de vacinas em desenvolvimento. O governo de lá apostara em fórmulas com plataformas diferentes, para ampliar as chances de conseguir um imunizante com rapidez. Pfizer e Moderna estavam entre as patrocinadas por Washington, além de Janssen, Novavax, Sanofi e, por fim, AstraZeneca. A empresa recebeu 1 bilhão de dólares para produzir 300 milhões de doses para os Estados Unidos. O diretor da operação, Moncef Slaoui, tinha sido meu chefe na GSK, onde trabalhou por cerca de trinta anos.
Para se aprofundar no tema:
- Livro: How to make a Vaccine
- Livro: Imunidade
- Podcast: Xadrez Verbal - Especial Coronavírus
Sobre a autora
Entrevista para o Roda Viva
Universidade de Oxford terá campus no Rio de Janeiro
A pesquisadora e professora brasileira Sue Ann Clemens, será a diretora da “Oxford carioca”. Clemens foi uma das responsáveis por trazer os estudos da vacina Oxford/AstraZeneca ao Brasil e diretora do primeiro mestrado em Vacinologia do mundo, na Universidade de Siena, na Itália.
“Nos últimos tempos, foram formados centros de estudos, e é triste perder isso quando a pandemia acabar. Queremos botar o Brasil na rota internacional de pesquisas“, disse Clemens ao Jornal Extra.
A professora e cientista que encabeçou projetos de capacitação em 22 centros na América Latina, revelou o objetivo de tornar o Brasil a sede de centros de pesquisas no subcontinente latino-americano.
No entanto, para ela, ainda é preciso investir em educação, preparando melhor os brasileiros para “povoarem esses centros” à medida que a produção de pesquisas crescer. Durante a pandemia, afirma, foi preciso “treinar pessoal em cima da hora”.
Conheça a cientista carioca que batalhou por acordo do Brasil com o Reino Unido para testar vacina de Oxford
No último dia 3, antes das 8h, Sue Ann Costa Clemens saiu de casa, no Jardim Botânico, rumo a Botafogo, para acompanhar o primeiro voluntário no Rio de Janeiro que receberia a vacina contra o novo coronavírus. Desenvolvida pela Universidade de Oxford, a fórmula, que passou a ser testada em brasileiros em junho — a meta é vacinar 5 mil pessoas entre Rio, São Paulo e Salvador —, iniciou sua rota rumo ao Brasil em 5 de maio.
Foi nesse dia que Clemens recebeu a ligação de Andrew Pollard, coordenador da pesquisa de Oxford. Ele a convidou, então, para ser a investigadora chefe dos testes clínicos da vacina no Brasil. Os dois são conhecidos de longa data — ele é professor do mestrado em Vacinologia, criado por ela na Universidade de Siena, na Itália, e trabalharam juntos em estudos para vacinas, como a da meningite. Pollard também sabia que Clemens havia coordenado os testes clínicos da vacina contra o rotavírus em meados de 2005, uma força-tarefa que recrutou pela América Latina mais de 60 mil voluntários em seis meses.